Redacción. Un equipo liderado por investigadores del Consejo Superior de Investigaciones Científicas (CSIC) relaciona por primera vez dos características comunes en los tumores: el cambio en las propiedades mecánicas, es decir, el grado de rigidez de las células del cáncer de mama y la alteración de su metabolismo. El descubrimiento abre la posibilidad de investigar nuevos tratamientos cuyo objetivo tenga como dianas las rutas bioquímicas involucradas en el metabolismo y la estructura interna de la célula. Los resultados se publican en la revista Communications Biology.
En la última década se ha comprobado, en una gran diversidad de tumores, que las células cancerosas son significativamente más blandas que las células sanas. “Esta propiedad podría estar relacionada con la facilidad con la que las células tumorales replican, pueden deformarse y pasar través de poros estrechos para introducirse en el torrente sanguíneo e invadir otro órgano, lo que se conoce como metástasis tumoral”, explican Marina López Yubero, autora principal del trabajo, y Javier Tamayo, director del proyecto científico, ambos del Instituto de Micro y Nanotecnología del CSIC (IMN-CNM-CSIC).
Mediante el microscopio de fuerzas atómicas los investigadores han usado una sonda que presiona en la célula y mide su grado de deformación. También han diseñado algoritmos que predicen las señales de deformación y la fuerza, obteniendo la rigidez de cada célula con una resolución sin precedentes. “El sistema permite distinguir con mucha claridad células sanas y tumorales y determinar su capacidad de producir metástasis”, añade Tamayo.
Metabolismo y propiedades mecánicas de las células tumorales
Los investigadores han encontrado que el cambio en las propiedades mecánicas de las células tumorales está relacionado estrechamente con su metabolismo anómalo, ya que estas consumen una gran cantidad de glucosa en comparación con las normales y así pueden crecer, sobrevivir y proliferar rápidamente. “Hemos investigado en células de cáncer de mama cuál es el efecto de eliminar los micronutrientes, incluida la glucosa, en las propiedades mecánicas. Sorprendentemente, la robustez mecánica de las células, sostenida por una estructura intracelular denominada citoesqueleto, se ‘desmorona’, como si una tienda de campaña se desplomara, ante la falta de energía”, detalla el investigador del CSIC.
Este fenómeno se observa en las células sanas así como en las células cancerosas muy invasivas capaces de producir metástasis, aunque de manera diferente. Mientras que las células sanas invierten su energía en una malla muy organizada de actina, una de las proteínas del citoesqueleto, para poseer una buena estructura, las células tumorales metastásicas carecen de dicha malla y emplean su energía en tensar la membrana celular con motores de unas proteínas denominadas miosinas, que se acoplan a las fibras de actina y les permiten desplazarse muy rápidamente para invadir otros órganos.
El estudio también analiza los efectos de la falta de energía en las células cancerosas que forman el tumor primario en la mama, pero que no provocan metástasis. En este caso, apenas se ve afectada la estructura mecánica y la deformabilidad de la célula. “Esto quiere decir que estas células presentan mecanismos muy eficientes y muy económicos para sostener su citoesqueleto incluso en condiciones muy extremas de ausencia de energía”, añade Tamayo.
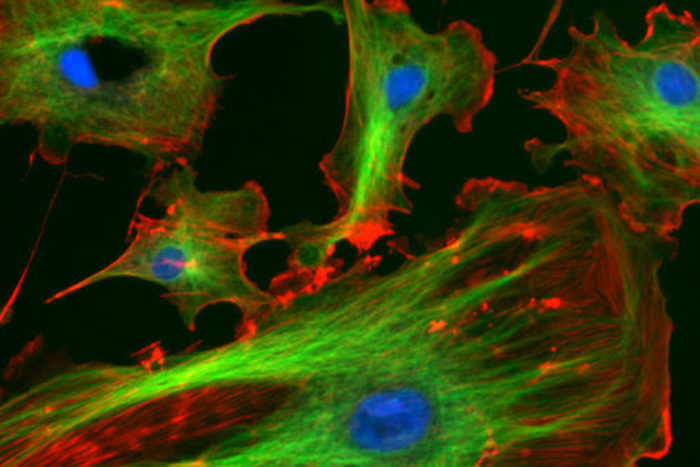
El citoesqueleto, la estructura que determina la rigidez de la célula
El citoesqueleto de las células, un entramado tridimensional de proteínas que les proporciona soporte interno, es la estructura responsable de las propiedades mecánicas de las células, es decir, cómo son de rígidas o de deformables. En particular, la malla que forman las fibras de una de las proteínas, la actina, debajo de la membrana celular, es la estructura más determinante. El citoesqueleto sería algo así como los palos que sujetan una tienda de campaña, y la tela, la membrana celular. La malla de actina serían los palos que van en la tela y proporcionan tensión a la tienda. Esta estructura no es permanente, sino que se desmantela y se reconstruye continuamente.
Los investigadores tratarán de averiguar si en otros tumores, como el cáncer de pulmón, las células se comportan de la misma forma, así como profundizar en el estudio en sistemas artificiales que simulan la estructura 3D de tumores reales. “El objetivo final es evaluar nuevos fármacos que tengan como dianas las rutas bioquímicas involucradas en el metabolismo y el citoesqueleto de la célula”, concluye Tamayo.