
Redacción. Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han descubierto la clave de la aparición de los dos primeros tipos de células de los mamíferos, que se establecen antes incluso de que se forme el embrión, en la etapa de desarrollo en la que los mamíferos están en la fase de blastocisto.
Los científicos del CNIC, en colaboración con investigadores del Hospital Sickkids de Toronto, Sloan-Kettering Institute y la Universidad de Kumamoto, han identificado un elemento regulador implicado en la función del gen que juega un papel más importante en la primera diferenciación celular que experimentan los mamíferos, que da lugar al tipo celular embrionario y extraembrionario. El hallazgo se publica en la revista Developmental Cell.
El blastocisto es una estructura embrionaria presente en las etapas tempranas del desarrollo de mamíferos, antes de la implantación en el útero materno. Está compuesto por entre 64 y 100 células que rodean una cavidad central. Antes de que el embrión alcance este estadio todas las células que lo forman son equivalentes y totipotentes, es decir, son capaces de formar todas las estructuras del embrión.
Pero con la formación del blastocisto ocurre la primera distinción entre células. En esta etapa del desarrollo temprano pueden suceder abortos espontáneos, generalmente debidos a que el embrión tiene defectos estructurales que le impiden desarrollarse.
Como consecuencia de esta primera decisión de linaje que ocurre en el blastocisto, se establecen dos poblaciones de células: las que darán lugar al trofectodermo (origen de la futura placenta) y las que formarán la masa celular interna, origen del resto del embrión y del organismo adulto.
“Esta segregación es clave ya que, por un lado, las células embrionarias pierden su totipotencialidad y, por otro, se genera un tejido, el trofectodermo, que es característico de mamíferos”, explica el Dr. Miguel Manzanares, principal autor del estudio. De este tejido se origina el trofoblasto que, tras diferenciarse en varios tipos celulares, forma la placenta y las membranas amnióticas. Es ahí donde juega un papel fundamental el gen Cdx2, esencial en la segregación del trofectodermo frente a la masa celular interna.
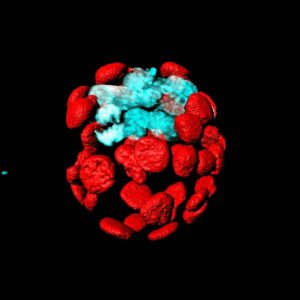

El equipo del doctor Manzanares, con Teresa Rayón (primera firmante del estudio) y Sergio Menchero, en colaboración el grupo del doctor José Luis de la Pompa –también del CNIC- y los investigadores del resto de entidades mencionadas, han identificado un elemento regulador de la función de Cdx2.
“El elemento que hemos descubierto dirige la expresión de un gen marcador de una manera restringida al trofectodermo, siendo esencial para comprender la información que recibe y procesa Cdx2 para activarse y ejercer su función”, subraya Teresa Rayón.
Además, han descubierto que la vía de señalización de Notch está implicada en la formación del trofectodermo junto con Tead4, un gen recientemente implicado en esta primera decisión. Los investigadores han caracterizado que la regulación conjunta y en paralelo de Notch y Tead4 se procesa sobre el elemento regulador de Cdx2 identificado, de tal forma que se garantiza el correcto desarrollo del embrión ya que demuestra que existen mecanismos de compensación en estos estadios de desarrollo para favorecer la viabilidad del embrión.
“Los aspectos importantes de la especificación temprana del trofectodermo se conservan entre humano y ratón por lo que el conocimiento de los procesos de formación de linajes murinos nos ayudará a comprender mejor lo que ocurre en humanos y favorecerá la mejora de las tecnologías de reproducción asistida”, apunta el Dr. Manzanares. “También facilitará la investigación de las influencias genéticas sobre la diferenciación de trofoblasto temprano tanto en condiciones normales, como en condiciones patológicas”, concluye.



